MAMMAKARZINOM
Regionale Chemotherapie beim primären und fortgeschrittenen metastasierten Mammakarzinom
Mit jährlich 70.000 Neuerkrankungen in Deutschland führt Brustkrebs die traurige Statistik der häufigsten Krebsarten bei Frauen an. Ca. 17.850 Frauen sterben jedes Jahr an der heimtückischen Krankheit. Derzeit erkrankt eine von acht Frauen im Laufe ihres Lebens an Brustkrebs. Dabei steigt das Risiko mit zunehmenden Alter. Jüngere Frauen sind nur selten betroffen, erst ab dem 40. und besonders ab dem 50. Lebensjahr erhöht sich das Risiko, um ab dem ca. 70. Lebensjahr wieder abzusinken. Das mittlere Erkrankungsalter für Brustkrebs liegt mit ca. 64 Jahren einige Jahre unter dem Durchschnitt aller Krebserkrankungen, wobei jede vierte Betroffene jünger als 55 Jahre und jede Zehnte jünger als 45 Jahre alt ist. Die Zahl der Sterbefälle sinkt seit einigen Jahren, und dieses trotz steigender Rate an Neuerkrankungen (1, 2). Das primäre Mammakarzinom ist heute erfolgreicher behandelbar als je zuvor – mit gezielteren und oft weniger belastenden Methoden.
Anders sieht es jedoch aus, wenn bereits eine Metastasierung vorliegt. Wenigstens ein Drittel der Frauen mit operablem Mammakarzinom bekommt Fernmetastasen trotz adjuvanter Chemotherapie, hormoneller- oder Strahlenbehandlung (3). Die mediane Überlebenszeit dieser Frauen, wenn sie auf Hormontherapie nicht mehr ansprechen und Rezeptor negativ sind, liegt bei etwa 2 Jahren und weniger als 5 % überleben die 5-Jahresgrenze (4). Bei triple-negativen Mammakarzinomen mit Lungenmetastasen ist die Überlebenszeit weitaus niedriger. Diese Patientinnen sind oft inoperabel und sprechen auf systemische Chemotherapie meist nicht an. Das metastasierte Mammakarzinom gilt per se als unheilbare Erkrankung, unabhängig von Faktoren wie Rezeptorstatus, Metastasierungsmuster, Tumortyp oder Vorbehandlung. Einzelne Faktoren wie guter Allgemeinzustand, langes rezidivfreies Intervall mit spätem Auftreten von Metastasen, rein ossäre Metastasierung oder Hormonrezeptorpositivität sprechen für eine etwas günstigere Prognose und es empfiehlt sich zunächst nur eine endokrine Therapie.
Im Gegensatz dazu ist in Fällen mit aggressivem Wachstum viszeraler Metastasen und sichtbarer rascher Tumorprogression eine Polychemotherapie indiziert. Ungeachtet besserer oder schlechterer Prognosefaktoren ist die Gesamtprognose jedoch infaust. Somit kommt dem Zugewinn an lebenswerter Überlebenszeit die größte Bedeutung zu, wie etwa bei antihormonell behandelten hormonrezeptorpositiven Patientinnen mit wenig progredienter Metastasierung.
Auch die Behandlung mit Biphosphonaten, welche Standard und fester Bestandteil der systemischen Therapie von Knochenmetastasen ist, vermag die Lebensqualität zu verbessern und die symptomfreie Überlebenszeit zu verlängern. Dies trifft nicht zu bei dosisdichter Chemotherapie, der Kombination von antihormoneller Therapie mit Chemotherapie, oder Hochdosischemotherapie, wo die Toxizität extreme Ausmaße annehmen und zum Therapieabbruch führen kann.
Eine Therapieoption stellt die auf Körpersegmente beschränkte regionale Chemotherapie dar, welche Zytostatikaresistenzen durchbrechen und unter geringer Toxizität eindrucksvolle Remissionen und Palliation schafft.

Quellen:
1. Deutsche Krebsgesellschaft, https://www.krebsgesellschaft.de/onko-internetportal/basis-informationen-krebs/krebsarten/brustkrebs-definition-und-haeufigkeit.html © 2019 Deutsche Krebsgesellschaft
2. Krebsinformationsdienst, krebsinformationsdienst.de/tumorarten/brustkrebs/fortgeschritten.php © 2019 Krebsinformationsdienst, Deutsches Krebsforschungszentrum
3. Lundin J, Lehtimaki T, Lundin M, et al: Generalisability of survival estimates for patients with breast cancer: A comparison across two population-based series. Eur J Cancer 42:3228-3235, 2006
4. Greenberg PA, Hortobagyi GN, Smith TL, et al: Long-term follow-up pf patients with complete remission following combination chemotherapy for breast cancer. J Clin Oncol 14:2197-2205, 1996
Primäres Mammakarzinom
Studie
Arteria-subclavia-Infusion als intra-arterielle Induktionschemotherapie
Die regionale Chemotherapie in Form der intra-arteriellen Infusion hat den Vorteil der Anflutung des Zytostatikums in höherer Konzentration und damit einer erhöhten Gewebeaufnahme im Zielgebiet mit daraus resultierender stärkerer Wirkung am Tumor (first-pass-effect). Niedrige Zytostatikakonzentrationen im venösen Abfluss aus der Tumorregion und damit reduzierte systemische Toxizität garantieren durchwegs sehr gute Lebensqualität.
Beim Brustkrebs ist in den letzten Jahren und Jahrzehnten eine zunehmende Tendenz zur Brusterhaltung zu verzeichnen: Die operative Entfernung lediglich des Tumorknotens wird mit Chemotherapie und Bestrahlung kombiniert. Die Chemotherapie wurde dabei eingesetzt um den Tumor zu verkleinern und damit auch den chirurgischen Eingriff gering zu halten. Eine eindrucksvolle Verkleinerung eines primären Brustkrebses mit systemischer Chemotherapie ist jedoch ein langwieriges Verfahren, welches nicht selten von starken Nebenwirkungen begleitet ist.
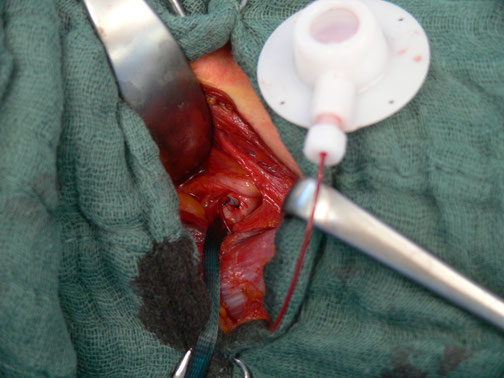
Abb. 1: End-zu-Seit Implantation des Port-Katheters in die A. subclavia
Um diese starken Nebenwirkungen zu umgehen und gleichzeitig ein schnelleres Schrumpfen des Tumors zu erreichen oder aber beim lokal, schon entfernten Tumor, ein
Rezidiv zu vermeiden, wurde in einer Studie an 53 Patientinnen mit primärem Brustkrebs die regionale Chemotherapie eingesetzt.
Bei allen Patienten wurde zunächst ein arterieller Portkatheter implantiert (Abb. 1)
Die Therapie bestand aus sechs Zyklen mit den Zytostatika Mitomycin, Adriamycin und Cisplatin in jeweils vierwöchigen Abständen. Bei 34 der 53 Patientinnen war der Tumor schon vor der intra-arteriellen Therapie (IAC) entfernt worden, bei 19 der 53 Patientinnen wurde eine neoadjuvante Chemotherapie durchgeführt und der Resttumor nach drei Therapiekursen unter Erhaltung der Brust lokal entfernt.
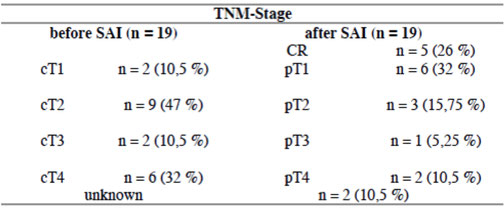
Tabelle: Downsizing von Primärtumoren nach 3 Zyklen der Subclavia-Infusion (SAI).
Für die Patientinnen selbst von wesentlicher Bedeutung, war die im allgemeinen sehr gute Lebensqualität bei erhaltener Leistungsfähigkeit und sehr selten, und dann nur geringfügig auftretendem Haarausfall. Die meisten Patientinnen waren zwischen den Behandlungszyklen voll arbeitsfähig. Die einzigen Nebenwirkungen waren Hautrötungen oder Erscheinungen, ähnlich wie nach Strahlentherapie, in 4% der Fälle. Die lokale Rezidivrate, lag nach 16 Jahren Nachbeobachtungszeit nur bei 17%. Im gleichen Zeitraum waren nur 7 der 53 Patientinnen verstorben, was heißt, dass nach diesem langen Zeitraum die mediane Überlebenszeit von 50% noch lange nicht erreicht war.
Ergebnisse kompakt
Bei 26% der Patientinnen war bei der histologischen Untersuchung kein Tumor mehr nachzuweisen – dies heißt bei jeder vierten Frau war er komplett zerstört – bei weiteren 48% war er stark verkleinert. Dies entspricht einer Gesamtansprechrate von 74%. Beim Vergleich der Tumordurchmesser nach drei Therapien, wurde eine deutliche Verschiebung von den hohen T3 und T4 Stadien zu den niedrigen T1 und T2 Stadien beobachtet.
Originalstudie:
Aigner KR, Gailhofer S, Selak E: Subclavian artey infusion as induction and adjuvant chemotherapy for breast conserving treatment of primary breast cancer. Cancer Ther 2008; 6: 67-72. https://www.medias-klinikum.de/app/download/7939994161/36.pdf?t=1638729352
Fortgeschrittenes, metastasiertes Mammakarzinom
Studie
Ergebnisse einer retrospektiven Beobachtungsstudie bei Lungenmetastasen des Mammakarzinoms
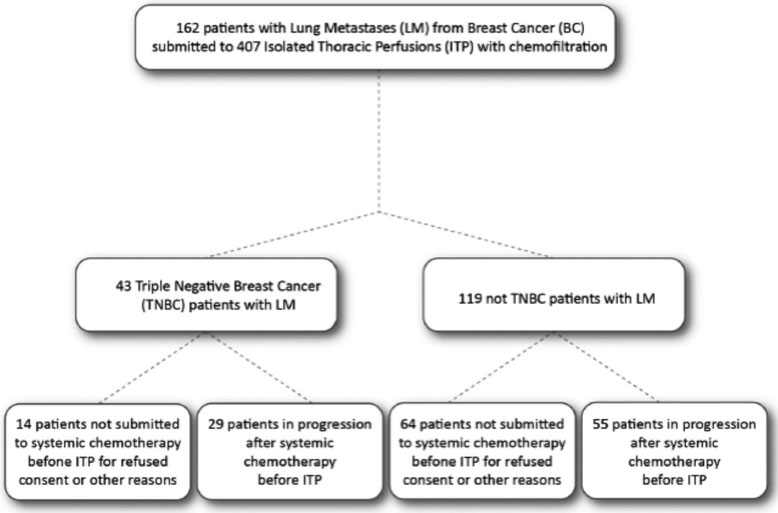
In einer im März 2019 in Updates in Surgery veröffentlichten retrospektiven Beobachtungsstudie in Kooperation mit der Universität L’Aquila und dem Nationalen Krebsinstitut Mailand (Fondazione IRCCS Istituto Nazionale Tumori Milano), mit 162 Patienten mit fortgeschrittenem metastasierten Mammakarzinom, wurde mit der regionalen Chemotherapie in Form der isolierten Thoraxperfusion eine mit den Daten anderer Krebsregister nahezu gleiche Überlebenszeit erreicht (Gesamtansprechrate bei ITP von 65,52 %).
Ein wesentlicher Vorteil dieser Methode zeichnete sich jedoch in der Untergruppe der mit systemischer Chemotherapie vorbehandelten und in Progression befindlichen Patienten aus. Hier konnte mit der isolierten Thoraxperfusion (ITP) eine mediane Überlebenszeit von 29 Monaten, gut ein halbes Jahr länger, bei sehr guter oder sogar einer Verbesserung der Lebensqualität erreicht werden.
Studiendesign
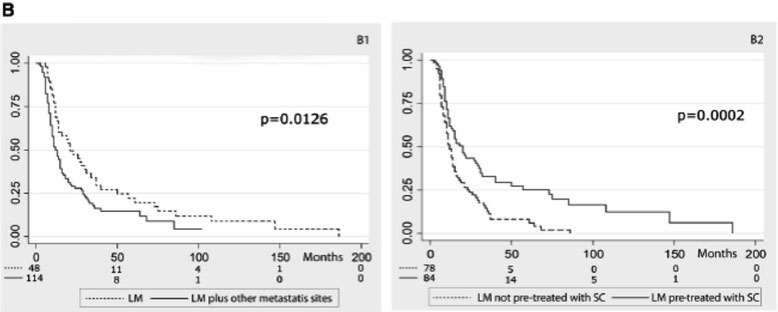
Percentages of complete responses (CR), partial responses (PR), stable disease (SD), progressive disease (PD), unknown response (Unknown) in the overall series (162 cases), and in the TNBC patients with LM (43 cases). b Kaplan–Meier survival curves in 162 breast cancer patients with LM treated by ITP. B1 Lung-limited metastatic site versus LM with other metastatic sites. B2 LM pretreated with systemic chemotherapy versus LM not pre-treated with systemic chemotherapy
Originalstudie:
Stefano Guadagni, Karl R. Aigner, et al. Isolated thoracic perfusion in lung metastases from breast cancer: a retrospective observational study. In: Updates in Surgery: https://doi.org/10.1007/s13304-018-00613-0
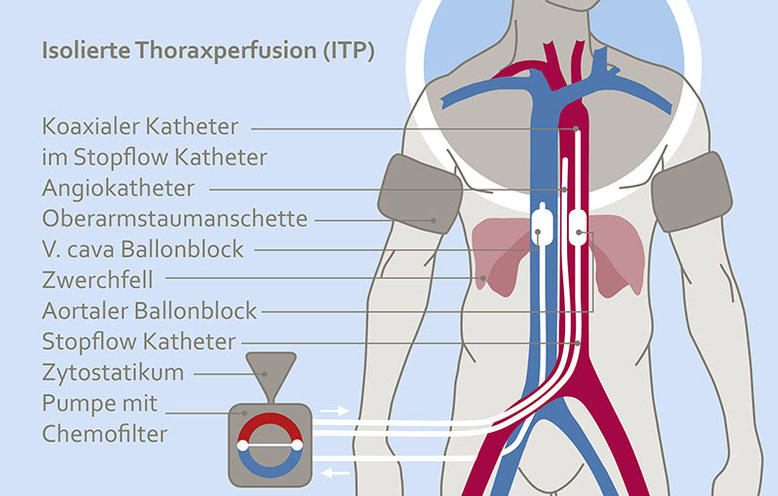
Die isolierte Thoraxperfusion
Lungenmetastasen und Thoraxwandrezidive treten meist nicht nur im Versorgungsgebiet einer Arterie auf, sondern auch außerhalb dessen. Durch spezielle, sogenannte “Stopflow“ Kathetersysteme welche über die Leistengefäße eingeführt werden, gelingt es mit geringem Aufwand den gesamten Thorax einschließlich der Lungen zu isolieren und Zytostatika in hoher Konzentration arteriell über die Aorta zu verabreichen. Die unmittelbar darauffolgende Chemofiltration senkt die systemischen Zytostatikaspiegel weitgehend, sodass bei reduzierter WHO I – II Toxizität die Lebensqualität kaum beeinträchtigt wird.
Ansprechraten von Thoraxwandrezidiven und Lungenmetastasen unterscheiden sich kaum. Sie liegen konstant über 70 % mit 25 % Komplettremissionen wobei einzuschränken ist, dass vorbestrahlte Thoraxwandrezidive bei denen die Bestrahlung länger als 6 bis 8 Monate zurückliegt, in Folge der Strahlenfibrose mit reduzierter Blutversorgung kaum bis gar nicht mehr ansprechen.
Die isolierte Thoraxperfusion mit Chemofiltration ist ein zweistündiger Eingriff und wird unter Vollnarkose protokollgemäß in vier Zyklen in vierwöchigen Abständen durchgeführt. Ist nach dem ersten Zyklus kein eindeutiges Ansprechen festzustellen, so wird das Therapieschema gewechselt. Spricht der Tumor auch daraufhin nicht an, so wird die Behandlung nach zwei Zyklen eingestellt. Die Mehrzahl der Patientinnen ist im fortgeschrittenen Stadium und pulmonal diffus metastasiert.
Die folgende Tabelle führt die jährlichen Überlebensraten in den ersten 4 Jahren für alle Patientinnen gemeinsam und selektiv für die FIGO-Stadien IIIC und IV auf.
Abb. 1: Schema der isolierten Thorax-Perfusion. Aufgrund des reduzierten zirkulierenden Blutvolumens sind Tumore höheren Konzentrationen von Zytostatika ausgesetzt.
Das Wirkprinzip ist leicht erklärt: Bei der regionalen Chemotherapie werden die Zytostatika unmittelbar in die Blutgefäße, die den Tumor und seine Umgebung versorgen, verabreicht. Dort entfaltet sie durch die hohe Wirkkonzentration die unmittelbare Wirkung am Tumor. Wie bei der systemischen Chemotherapie gelangen auch bei der RCT Zellgifte in den Blutkreislauf, jedoch zu gering um den Patienten zu schädigen oder größere Nebenwirkungen zu verursachen. Je nach Art, Größe und Metastasierung eines Tumors wird eine bis zu 10-fache, in schwierigen Fällen auch bis zu 70-fache, Zytostatikakonzentration erreicht.
Für den Gesamtorganismus bestehen trotzdem weitaus weniger Nebenwirkungen als bei einer herkömmlichen Therapie, da mit Hilfe der systemischen Entgiftung, der sogenannten Chemofiltration, das Blut im Anschluss an jeden Eingriff gereinigt wird. Dementsprechend kommt es hier auch zu wesentlich geringeren gesundheitlichen Belastungen für Betroffene. Dies trifft beim Mammakarzinom insbesondere bei der Behandlung von Lungenmetastasen mittels der Technik der isolierten Thoraxperfusion zu.
Ziel der Behandlung ist es, die Erkrankung über möglichst lange Zeit zu kontrollieren, tumorbedingte Symptome zu verhindern und vor allem die Lebensqualität zu erhalten oder sogar zu verbessern.
Lebermetastasen und Peritonealkarzinose
Zur regionalen Chemotherapie von Lebermetastasen des Mammakarzinoms wurden bislang keine evidenzbasierten Daten publiziert, da das Mammakarzinom als potenziell systemische Erkrankung gilt und damit vorneweg die Indikation zur systemischen Therapie besteht. Das Problem dabei ist nur, dass Lebermetastasen sehr lebensbedrohend sein können und mit einer lokalen Zytostatikaexposition, wie sie bei systemischer Therapie erreicht wird, nur schwer zu beeinflussen sind – und wenn, dann unter Inkaufnahme sehr starker Toxizität. Da Lebermetastasen des Mammakarzinoms meist diffus und in größerer Zahl auftreten, eignet sich zur Induktionstherapie am besten die intraarterielle Infusion oder auch Transarterielle Chemoembolisation der Leber (TACE), welche angiographisch oder über chirurgisch platzierte Portkatheter durchgeführt werden. Mit geeigneten Ballonkathetertechniken der isolierten Oberbauch- oder abdominellen Perfusion können regionale Lymphgebiete und peritoneale Herde einer gesteigerten Wirkkonzentration ausgesetzt werden.
Entscheiden für den Erfolg ist im speziellen Fall wiederum das Chemotherapieschema selbst mit Art, Konzentration und Zeitintervall der Verabreichung. Klinische Daten weisen auf eine eindeutige Korrelation zwischen lokaler Zytostatikaexposition und klinischem Ansprechen hin.
Regionale Anwendungen der Chemotherapie beim metastasierten Mammakarzinom sind, gleichwohl sie in den wenigen bislang vorliegenden Studien sehr gute Ansprechraten und auch
Überlebenszeiten bewirkt haben, noch nicht weit verbreitet und praktiziert. Ihr Vorteil ist die geringere Toxizität und Erhaltung der Lebensqualität bei einer Tumorerkrankung welche derzeit nicht
heilbar ist. Weitere Studien mit dem Ziel in der Behandlung des metastasierten Mammakarzinoms bei beschränkter Lebenserwartung zumindest die Lebensqualität wiederherzustellen und zu erhalten sind
erforderlich und im Gange.
Triple-negativer Brustkrebs (TNBC)
Studie
Arterielle Infusion und isolierte Perfusion in Kombination mit reversibler Elektroporation bei lokal rezidiviertem, inoperablem Brustkrebs
Zusammenfassung
Hintergrund:
Rezidivierter, inoperabler, triple-negativer Brustkrebs ist eine herausfordernde Erkrankung, für die es nur wenige Behandlungsmöglichkeiten gibt. Vor allem das Vorliegen inoperabler Tumormassen bedarf einer Behandlung, die zu einer schnellen Tumorschrumpfung führt. Dabei müssen systemische Nebenwirkungen für Patient:innen, die von vorangegangenen Behandlungslinien erschöpft sind, vermieden werden. Die reversible Elektroporation hat sich bei Brustkrebs als wirksam erwiesen, wenn sie mit systemischem Bleomycin und/oder Cisplatin kombiniert wird. Um die lokale Wirkung zu verstärken und die systemischen Nebenwirkungen zu reduzieren, haben wir die reversible Elektroporation mit einer regionalen Chemotherapie kombiniert.
Material und Methoden:
Patientinnen mit fortgeschrittenem metastasiertem und rezidiviertem Brustkrebs erhielten eine regionale Chemotherapie mittels intraarterieller Infusion und isolierter Thoraxperfusion in Kombination mit perkutaner reversibler Elektroporation. Das Ansprechen des Tumors wurde mittels CT-Kontrolle beurteilt und zudem zirkulierende Tumorzellen vor und 24 Stunden nach der Behandlung gezählt.
Ergebnisse:
Es wurden 21 Behandlungen bei 14 Patientinnen (mittlere Tumorgröße 7,6 cm, SD 3,3 cm) durchgeführt. Die Anzahl zirkulierender Tumorzellen ging in 11 Fällen zurück, blieb in 8 Fällen nach der Behandlung stabil und nahm in zwei Fällen zu. Bei 13 Patientinnen wurde ein klinisches Ansprechen mit einer Schrumpfung des Tumors beobachtet, die zur Resektabilität führte. Eine Patientin sprach nicht auf das Behandlungsschema an.
Schlussfolgerungen:
Die Kombination von reversibler Elektroporation mit intra-arterieller Chemotherapie ist durchführbar und führt zu einem guten klinischen Ansprechen mit vernachlässigbaren Nebenwirkungen. Die Behandlung kann wiederholt werden und zur Resektabilität führen.
Präsentation des Falles
Einführung
Die Behandlung von Brustkrebs ist gut etabliert, mit spezifischen Ansätzen für verschiedene Subtypen. Hormonrezeptor-positiver Brustkrebs hat eine gute Prognose mit einer 10-Jahres-Überlebensrate von 85–90% bei frühzeitiger Diagnose. Für HER2-positiven Brustkrebs wurden die Behandlungsmöglichkeiten durch gezielte HER2-Therapien und Antikörper-Wirkstoff-Konjugate erheblich verbessert. Triple-negativer Brustkrebs (TNBC), der etwa 15% der Fälle ausmacht, ist unabhängig von Hormonrezeptoren und HER2 und spricht daher nicht auf entsprechende Therapien an. Das gilt v.a. für fortgeschrittenen TNBC, wo die Überlebensraten nur 8–13 Monate betragen.
Einige Patientinnen mit metastasiertem Brustkrebs benötigen systemische Behandlungen. Bei Erschöpfung durch mehrere Therapiezyklen kann dabei eine lokoregionale Behandlung von schmerzhaften oder lebensbedrohlichen Metastasen sinnvoll sein. Schnell wachsende Rezidive des Primärtumors, insbesondere wenn sie groß sind oder mit Ulzerationen oder Blutungen verbunden, können starke Schmerzen und psychische Belastungen verursachen. Diese Tumoren sprechen oft nicht mehr auf systemische Chemotherapien an.
Reversible Elektroporation, bei der mittels elektrischer Spannungen Tumorzellen durchlässiger für Medikamente gemacht werden, zeigt bei Brustkrebs vielversprechende Ergebnisse. Diese Methode wird typischerweise mit einer systemischen Chemotherapie kombiniert. Eine regionale Chemotherapie kann im Vergleich dazu die lokale Wirkstoffkonzentration und -effizienz maximieren und die systemischen Nebenwirkungen minimieren.
Die vorliegende Arbeit setzte erstmals eine Kombination von reversibler Elektroporation mit arterieller Infusion und isolierter Perfusion für die Therapie des rezidivierten, inoperablen TNBC ein. Es wurden Machbarkeit, Sicherheit und lokale Effekte untersucht, einschließlich möglicher Risiken wie einer erhöhten Metastasierung durch zirkulierende Tumorzellen.
Material und Methoden
Es wurden Patientinnen mit rezidiviertem und/oder chemoresistentem Mammakarzinom und inoperabler Tumormasse an der Primärstelle behandelt, deren Tumoren Schmerzen, Blutungen oder psychische Belastungen verursachten, wobei nicht akut lebensbedrohliche Fernmetastasen zulässig waren. Die Behandlung erfolgte durch eine Kombination aus reversibler Elektroporation, einer arteriellen Infusions-Chemotherapie mit einer Dreifachkombination aus Cisplatin, Doxorubicin und Mitomycin und einer isolierten thorakalen Perfusions-Chemotherapie. Zirkulierende Tumorzellen (CETCs/CTCs) wurden vor und 24 Stunden nach dem Eingriff mittels EpCAM Antikörper-Bindung fluoreszenzmarkiert und quantifiziert. Details zur Methodik der Behandlung und der Dosierung der Chemotherapeutika sind der Originalstudie zu entnehmen.
Abb. 1: 14 Patienten mit den in (A) beschriebenen Krankheitsmerkmalen wurden in 21 Behandlungszyklen behandelt. Die individuellen Patientenmerkmale und das Ansprechen auf die Behandlung sind in (B) beschrieben.
Ergebnisse kompakt
Patienten und Behandlungen:
- Die Patientinnen hatten chemoresistente oder lokal rezidivierende Brustkrebserkrankungen im FIGO-Stadium III/IV und ein Durchschnittsalter von 51 Jahren. 12 Patientinnen hatten TNBC und 2 waren resistent gegen eine Anti-Hormontherapie.
- Die mittlere Größe der behandelten Läsionen betrug 7,6 cm (SD 3,3 cm). Fünf Patientinnen hatten ulzerierte Läsionen, acht Patientinnen hatten Fernmetastasen.
- Fernmetastasen wurden mit isolierter regionaler Perfusion oder TACE therapiert.
Zirkulierende Tumorzellen (CETCs/CTCs):
- CETCs/CTCs wurden vor der Behandlung in 14 von 21 Zyklen nachgewiesen, wobei deren Zahl in 11 Zyklen nach der Therapie abnahm und in einem Fall konstant blieb.
- Ein Anstieg der CETCs/CTCs trat in zwei Fällen auf, in denen die Dauer der Elektroporation die Dauer der Arzneimittelexposition überstieg, In einem dieser Fälle wurde der Primärtumor resektabel, die Patientin entwickelte aber 2 Monate später eine massive Lebermetastasierung.
- In sieben Fällen wurden weder vor noch nach der Behandlung CETCs/CTCs nachgewiesen.
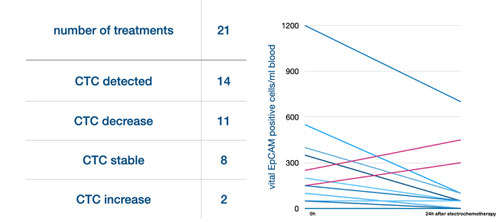
Abb. 2: Ergebnisse für CETCs/CTCs.
Lokale Ansprechraten:
- Bis auf einen Fall schrumpfte der Tumor in allen Fällen 2-7 Tage nach jedem der 21 Zyklen.
- Radiologische Kontrollen 4-8 Wochen nach der Behandlung zeigten im Median eine Schrumpfung des größten Tumordurchmessers um 45%, in zwei Fällen ein vollständiges Ansprechen und in vier Fällen eine R0-Resektabilität.
Gesamtüberleben:
- Die mediane Gesamtüberlebenszeit betrug 13 Monate, bei Patientinnen im Stadium IV 10,5 Monate, bei Patienten im Stadium III 17,5 Monate.
Unerwünschte Wirkungen:
- Nebenwirkungen waren allgemein gering; Neutropenie überstieg nicht Grad 2, Hand-Fuß-Syndrom trat nicht auf.
- Leichte Übelkeit und Haarausfall waren selten, während Infektionen an der Katheterstelle und andere Nebenwirkungen minimal waren.
Diskussion
In dieser Pilotstudie wurden reversible Elektroporation mit regionaler Chemotherapie kombiniert, um die lokale Medikamentenwirkung zu erhöhen und gleichzeitig die systemischen Nebenwirkungen bei fortgeschrittenen Brustkrebspatientinnen mit inoperablen rezidivierenden Tumoren zu minimieren. Die Verfahren waren erfolgreich und sicher und führten in 19 von 21 Fällen zu keinem Anstieg der zirkulierenden Tumorzellen. Dabei ist sorgfältige Planung entscheidend, um Risiken im Zusammenhang mit einer längeren Elektroporation zu vermeiden. 2. Eine Limitation der Studie ist die kleine, heterogene Patientengruppe, jedoch unterstützen die vielversprechenden Ergebnisse weitere klinische Studien zur Optimierung dieses Ansatzes für fortgeschrittene Krankheitsfälle.
Schlussfolgerung
Die Kombination von reversibler Elektroporation mit intraarterieller Chemotherapie oder isolierter Perfusion ist gut durchführbar und bedingt ein gutes klinisches Ansprechen mit vernachlässigbaren Nebenwirkungen. Die Behandlung scheint wiederholbar zu sein und kann zu einer Resektabilität führen. In bestimmten Fällen könnte jedoch die isolierte Perfusion wirksamer und sicherer sein, was die Tumorabdeckung und die Vermeidung eines erhöhten Metastasierungsrisikos betrifft.
Weitere Literatur
Karl Reinhard Aigner and Nina Knapp: Toxicity Profiles with Systemic Versus Regional Chemotherapy. In: Induction Chemotherapy – Systemic and Locoregional, 2nd Edition, pp 497-505, Springer Press, 2016
Karl Reinhard Aigner, Stefano Guadagni, and Giuseppe Zavattieri: Regional Chemotherapy for Thoracic Wall Recurrence and Metastasized Breast Cancer. In: Induction Chemotherapy – Systemic and Locoregional, 2nd Edition, pp 173-185, Springer Press, 2016
Karl R. Aigner, Stefano Guadagni, Giuseppe Zavattieri: Regionale Chemotherapie beim Thoraxwandrezidiv und metastasierten Mammakarzinom. In. Regionale Therapie maligner Tumoren. Aigner, Stephens, Vogl, Padberg (eds), pp 153-163, Springer Verlag, 2013
Aigner KR: Regionale Chemotherapie beim primären und metastasierten Mammakarzinom. Deutsche Zeitschrift für Onkologie 41:1-4, 2009