IMMUNTHERAPIE
Das Immunsystem ist prinzipiell in der Lage Krebszellen zu erkennen und anzugreifen. Wenn eine Zelle entartet, wird sie in den meisten Fällen vom Immunsystem erkannt und vernichtet. Jedoch kann es passieren, dass veränderte Zellen dem Immunsystem entkommen und ungehindert wachsen und sich vermehren. Dann entsteht Krebs.
Die moderne Krebstherapie zielt unter anderem darauf ab, den natürlichen Mechanismus des Immunsystems zu nutzen, um Krebserkrankungen zu bekämpfen. Dazu muss einerseits sichergestellt werden, dass das Immunsystem den Tumor erkennt, und andererseits jegliche Schutzmechanismen (Escape-Mechanismen) der Krebszelle gegenüber den Immunzellen verhindert werden. Die Immuntherapie kommt heute z. B. bei Lungenkrebs, Karzinomen im Kopf-Hals-Bereich, Blasenkrebs, Hautkrebs sowie bei bestimmten Brustkrebsarten zum Einsatz.
Für eine gelungene Immuntherapie müssen also mehrere Schritte im Auge behalten werden. Die Funktion der Erkennung von bösartigen Zellen muss sichergestellt sein und ebenso die Beseitigung von Escapemechanismen. Sonst kann eine Immuntherapie unter Umständen nicht den gewünschten Erfolg erreichen.
Nicht immer bedarf es für alle Schritte der körpereigenen Immunwirkung einer therapeutischen Unterstützung. Oft hapert es nur an einem der vielen notwendigen Vorgänge. Dies gilt es mit moderner Diagnostik zu erkennen.

Das Immunsystem zur spezifischen Aktivität gegen den Tumor aktivieren
Interventionell onkologische Therapien sind Maßnahmen, welche gezielt lokal den Tumor angreifen. Das Therapiegebiet ist also auf das Tumorgebiet beschränkt. In vielen laufenden und teils abgeschlossenen Studien wurde gezeigt, dass eine lokale Tumorzerstörung das Immunsystem aktivieren kann. Dies passiert, wenn durch die lokale Therapie einige der Krebszellen zerstört werden und deren Zellfragmente und Proteine in die Blutbahn gelangen und dort auf Immunzellen treffen. Die Erkennung der Zellfragmente und Proteine durch Immunzellen führt zu deren spezifischen Aktivierung und damit zur Bekämpfung weiterer Krebszellen.
Dieser Vorgang ist jedoch nur möglich, wenn das Immunsystem grundsätzlich intakt ist. Leider ist dies, besonders bei stark vorbehandelten PatientInnen, oft nicht mehr der Fall. Eine genaue Untersuchung des Immunstatus ist hier wichtig, um Klarheit zu schaffen.
Es gibt außerdem Mechanismen, die dem Tumor ermöglichen dem Immunsystem zu entweichen. Auch dies kann durch präzise Diagnostik erkannt werden und mit einer passenden Immuntherapie verhindert werden. Hier steuert die Therapie mit sogenannten Checkpoint-Inhibitoren meist erfolgreich entgegen.
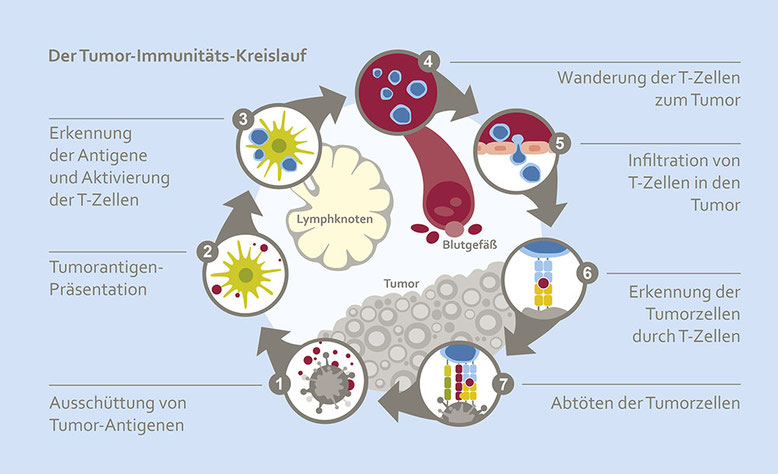
Erkennung von Krebszellen durch das körpereigene Immunsystem
T-Lymphozyten sind eine bestimmte Unterart von Immunzellen. Sie können Krebszellen von gesunden Zellen unterscheiden, wenn diese veränderte Merkmale, sogenannte Neoantigene, aufweisen. Auf solche Neoantigene werden sie aufmerksam, wenn diese von antigenpräsentierenden Zellen gezeigt werden. Dendritische Zellen gehören zu den antigenpräsentierenden Zellen. Sie werden durch die Aufnahme von Antigenen (und Neoantigenen der Krebszellen) aktiviert und wandern in die regionären Lymphknoten. Dort werden die Antigene den T-Lymphozyten durch die dendritischen Zellen präsentiert. Durch den Kontakt mit dendritischen Zellen wiederum, werden die T-Lymphozyten aktiviert, gelangen in die Blutbahn und greifen Zellen mit dem entsprechenden Antigen (also auch Krebszellen mit dem entsprechenden Neoantigen) an.
Für eine gelungene Immunantwort muss jeder dieser Schritte stattfinden. An verschiedenen Stellen dieses Ablaufes kann therapeutisch nachgeholfen werden.
Krebsimpfung mit Neoantigenen
Tumor-spezifische Antigene werden im Fachjargon auch „Tumor Neoantigene“ genannt. Dies sind kleine Proteinfragmente (sogenannte „Peptide“), die ausschließlich auf Krebszellen vorkommen. Das selektive Vorkommen auf Krebszellen kann man sich therapeutisch zunutze machen, indem man das Immunsystem durch aktive Immunisierung (Impfung) gezielt gegen diese einzigartigen Strukturen richtet. Dadurch kann der Tumor hochspezifisch therapiert werden, während gesunde Körperzellen von der therapeutischen Intervention verschont bleiben.
Diese Therapie ist jedoch noch nicht ausreichend erforscht um ihre Wirkung zu beweisen. Eine Behandlung ausschließlich mit Neoantigenimpfung wird daher noch nicht empfohlen.
Bestimmung von Neoantigenen für die Krebsimpfung
Es wird eine Biopsie des Tumors und eine Blutabnahme am Patienten durchgeführt. Durch den Vergleich mit gesunden Zellen aus dem Blut lassen sich detaillierte Erkenntnisse über das molekulare Profil des Tumors gewinnen.
Die Proben werden in ein Speziallabor gesendet, welches die Sequenzierung des Exoms durchführt. Das ist jener Teil des Genoms, der Protein-kodierend und damit sichtbar für das Immunsystem ist. Dies geschieht sowohl für den Tumor als auch für die gesunden Blutzellen.
Beim anschließenden Tumor-Profiling wird aus der oben erstellten Sequenzierung ein Bericht erstellt, welche molekularen Abweichungen, also welche Neoantigene, der Tumor hat.
Wirkung und Nebenwirkung der Krebsimpfung
Die Impfung mit Neoantigenen zur Behandlung von Krebserkrankungen ist eine neue Methode, welche laut erster Studien sehr vielversprechend ist. Da die Immunzellen spezifisch auf die individuellen Molekülstrukturen des patienteneigenen Tumors aktiviert werden, ist eine sehr gezielte Wirkung und wenig bis keine Nebenwirkungen zu erwarten.
Allerdings gibt es noch nicht genügend Studienergebnisse um genaue Aussagen über Wirkung und Nebenwirkungen zu machen. Die Methode ist noch nicht offiziell als Behandlungsmethode zugelassen und wird derzeit in Studien untersucht. Die Krebsimpfung mit Neoantigenen kann daher nicht eine vollständige Krebstherapie ersetzen und stellt einen individuellen Heilversuch dar.

Die Balance des Immunsystems
Das Immunsystem muss eine geeignete Balance einhalten zwischen Aktivierung und Supprimierung. Das bedeutet, es muss ausreichend aktiv sein um Erreger, infizierte Zellen und Krebszellen zu bekämpfen. Gleichzeitig dürfen die Immunreaktionen nicht überschießen, denn dann können Allergien und Autoimmunreaktionen, also Reaktionen gegen gesunde Körperzellen die Folge sein.
Bei Krebspatienten ist es daher sinnvoll, den Immunstatus festzustellen, vor allem wenn eine Immuntherapie geplant ist.
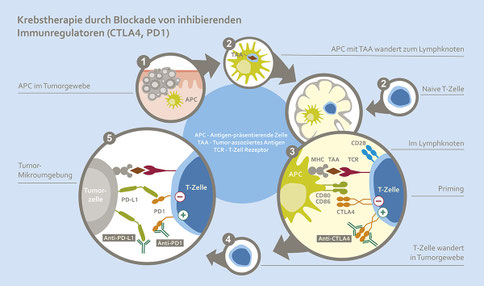
Checkpoints – die Kontrollpunkte des Immunsystems
Um genau diese Balance einzuhalten gibt es bestimmte Kontrollpunkte — sogenannte Checkpoints — auf den Körperzellen und Immunzellen. Diese Checkpoints kontrollieren gewissermaßen die Notwendigkeit des Eingreifens des Immunsystems.
Diesen Mechanismus machen sich Krebszellen gelegentlich zu Nutze indem sie Checkpoints auf der Oberfläche präsentieren, welche dem Immunsystem ein Signal zum Nicht-Angreifen übermitteln. So können Krebszellen dem Immunsystem in manchen Fällen entkommen.
Checkpoint-Inhibitoren – Die Bremse des Immunsystems lösen
In Fällen, wo Checkpoints das Angreifen von Immunzellen auf Krebszellen verhindern, kann eine Immuntherapie mit einem sogenannten Checkpoint-Inhibitor sinnvoll sein. Checkpoint-Inhibitoren besetzen den Checkpoint so, dass das „Nicht-Angriffs-Signal“ nicht mehr von den Immunzellen gesehen wird. Eine körpereigene Immunwirkung gegen die Krebszellen kann dann stattfinden.
Wirkung und Nebenwirkungen der Checkpoint-Inhibitoren
Checkpoint-Inhibitoren können also durch die Unterbrechung der „Nicht-Angriffs-Signalübertragung“ dazu führen, dass das körpereigene Immunsystem erfolgreich gegen den Krebs arbeitet. In vielen Fällen hat dies zu herausragenden Behandlungserfolgen geführt.
Damit die Wirkung allerdings auch zustande kommt, müssen die Immunzellen zunächst auch den Krebs erkennen und tatsächlich am Krebs ankommen. Beides ist nicht immer der Fall und dann ist die Wirkung der Checkpoint-Inhibitoren eingeschränkt.
Es gibt oft Möglichkeiten den Status des Immunsystems im Blut und anhand einer Biopsie auch im Tumor festzustellen.
Checkpoint-Inhibitoren können, da sie das Immunsystem enthemmen, auch dazu führen, dass gesunde körpereigene Zellen vom Immunsystem angegriffen werden. Dann können Autoimmunreaktionen entstehen. Zu diesen Nebenwirkungen gehören unter anderem Hautreaktionen, Lungenentzündung oder Dickdarmentzündung welche einen Therapieabbruch nötig machen können.
Diagnostik – Wissen wo es hakt im Immunsystem
Wie für eine gelungene Krebsbehandlung eine intensive Diagnostik immer nötig ist, sollte eine Immuntherapie auch mit entsprechender Feststellung des Immunstatus verbunden sein. In einer Blutprobe können die verschiedenen Immunzellen und Immunsignalstoffe (Zytokine) untersucht werden.

Auch der Immunstatus direkt im Tumor kann wichtig sein bei einer Therapieentscheidung. An einer Tumorprobe, welche oft durch einen kleinen Eingriff oder eine Nadelbiopsie gewonnen wird, wird untersucht welche und wie viele Immunzellen im Tumor vorhanden sind, ob diese aktiv sind oder ob sie von Checkpoints oder einem ungünstigen Tumor-Mikromilieu gebremst werden